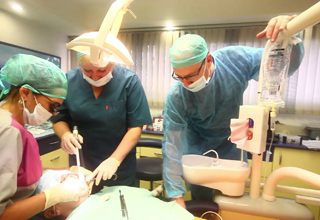
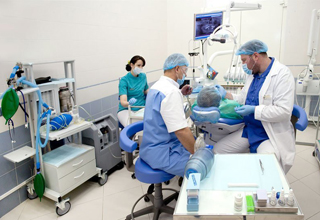
Специалисты по лечению зубов во сне
Седация не является наркозом, это только лёгкий поверхностный сон. Хотя по ощущениям пациент и пребывает во сне, но он находится в сознании и реагирует на голос врача, выполняет его указания. Что очень важно, все неприятные ощущения при этом сведены к минимуму. Седация в стоматологии – новое, но стремительно набирающее популярность направление.
На протяжении всего времени, пока в условиях седации выполняются стоматологические манипуляции, проводится постоянное наблюдение за состоянием пациента и за показателями всех его систем и органов.
Для каждого пациента вариант седации врач подбирает индивидуально, с учётом всех показаний и противопоказаний к предстоящему лечению. Благодаря этому удаётся достичь наилучших результатов не только в выполнении конкретной процедуры, но и в плане реакции организма на лечение.
Препараты, которые используются для лечения зубов во сне, не содержат наркотических веществ и не вызывают привыкания.
Довольно часто у людей с определёнными заболеваниями стрессовая ситуация, связанная с посещением стоматолога, провоцирует отягощение существующей патологии. Отзывы пациентов, проводивших лечение зубов во сне, подтверждают, что страха при этом не возникает и все манипуляции, независимо от их объёма, переносятся гораздо легче. Лечение зубов под седацией показано при наличии:
- эндокринных нарушений;
- проблем с иммунной системой;
- патологий дыхательной системы;
- болезней сердечнососудистой системы;
- аллергических реакций.
Если у пациента наблюдается повышенный рвотный рефлекс, то «сон» во время лечения поможет купировать это неприятное состояние и даст возможность врачу быстро выполнить все необходимые действия.
Лечение зубов во сне – хорошее решение для тех пациентов, кому требуется провести работы в большом объёме, например, за один сеанс удалить и вылечить зубы, установить импланты.
Такое лечение также показано людям, которые панически боятся визита к стоматологу. В основном это пациенты от 30 до 65 лет, которые ещё помнят стоматологию советских времён и связанные с ней детские страхи.
Противопоказаниями к лечению зубов во сне служат:
- обострения хронических заболеваний;
- тяжёлые формы сахарного диабета;
- декомпенсированные формы сердечнососудистых болезней;
- черепно-мозговые травмы;
- заболевания крови;
- бронхиальная астма;
- алкогольная и наркотическая зависимость;
- переполненный желудок;
- беременность, так как любые препараты проникают через плацентарный барьер и способны негативно повлиять на состояние плода;
- кормление грудью.
Перед проведением лечения нужно обязательно рассказать врачу о принимаемых на данный момент лекарствах, чтобы он мог учесть возможные лекарственные взаимодействия.
Заявка отправлена
, спасибо за проявленный интерес. В течение 15 минут наш менеджер перезвонит вам.
Закрыть
Довериться нам можно по нескольким причинам:
- Мы – надёжные, и на доверие к нам мы ответим качественным результатом. Мы гарантируем высокое качество всех предоставляемых услуг.
- Мы – успешные. Огромный опыт и профессионализм наших специалистов позволяет выполнять задачи любого уровня сложности. Подтверждением этому стали фотографии наших счастливых пациентов, которые были сделаны до и после посещения наших специалистов.
- Мы используем новейшие разработки в области стоматологии, а также сертифицированные материалы и препараты от лучших мировых производителей.
- Мы стараемся максимально деликатно выполнять все стоматологические манипуляции. Наши клиники – одни из немногих в Москве, где пациентам предлагается возможность проводить лечение зубов под седацией. Мы также предлагаем уникальную авторскую методику премедикации с дальнейшей седацией.
- Мы – лояльные. Стоимость расходных материалов и цены на наши услуги комфортны для наших пациентов. Как подтверждают отзывы многочисленных пациентов, у нас самые доступные цены в Москве на все виды стоматологических услуг.
Вопрос успешно отправлен
, мы передадим ваш вопрос специалисту и дадим ответ на этой странице. Обращаем внимание, что в связи с большим количеством вопросов и загруженностью врачей, время ответа увеличено. Добавьте сайт в закладки, чтобы не пропустить ответ.
Закрыть
Статью проверил эксперт
Климович Виктория Борисовна
Квалифицированный специалист в области ортодонтии, челюстно-лицевой хирургии и эстетической реставрации зубов, опыт работы - 11 лет
Оцените качество страницы:
0 голосов, 0.0 из 5